鋰電池廠家總結:鋰離子電池電化學測量方法解析
鋰電池廠家總結:鋰離子電池電化學測量方法解析。鋰離子電池電極過程動力學探究中常用的有循環伏安法(CV)、電化學阻抗譜(EIS)、恒電流間歇滴定技術(GITT)、恒電位間歇滴定技術(PITT)、電流脈沖弛豫(CPR)、電位階躍計時電流(PSCA)和電位弛豫技術(PRT)等。
鋰電池的電極反應主要包括哪些?
電池中電極過程一般包括溶液相中離子的傳輸,電極中離子的傳輸,電極中電子的傳導,電荷轉移,雙電層或空問電荷層充放電,溶劑、電解質中陰陽離子,氣相反應物或產物的吸附脫附,新相成核長大,與電化學反應耦合的化學反應,體積變化,吸放熱等過程。這些過程有些同時進行,有些先后發生。
電極過程的驅動力包括電化學勢、化學勢、濃度梯度、電場梯度、溫度梯度。
分清兩電極和三電極
電化學測量一般采用兩電極電池或三電極電池,較少使用四電極電池。
兩電極
兩電極由研究電極(W),亦稱之為工作電極和輔助電極(C),亦稱之為對電極組成。鋰電池的研究中多數為兩電極電池,兩電極電池測量的電壓是正極電勢與負極電勢之差,無法單獨獲得其中正極或負極的電勢及其電極過程動力學信息。
三電極
三電極電池包括,W和C分別是工作電極和對電極,R是參比電極。W和C之間通過極化電流,實現電極的極化。W和R之間通過極小的電流,用于測量工作電極的電勢。
通過三電極電池,可以專門研究工作電極的電極過程動力學。
參比電極的特征
1、參比電極應為可逆電極:
2、不易被極化,以保證電極電勢 比較標準和恒定:
3、具有較好的恢復特性,不發生 嚴重的滯后現象;
4、具有較好的穩定性和重現性;
5、快速暫態測量時,要求參比電極具有較低的電阻,以減少干擾,提高測量系統的穩定性;
6、不同的溶液體系,采用相同的參比電極的,其測量結果可能存在差異,誤差主要來源于溶液體系間的相互污染和液接界電勢的差異。
常用的參比電極
水溶液體系參比電極:可逆氫電極、甘汞電極、汞一氧化汞電極、汞一硫酸亞汞電極等;
非水溶液體系參比電極:銀一氯化銀電極、Pt 電極以及金屬鋰、鈉等電極。
其他:也可以用銀絲、鉑絲做準參比電極,或者采用電化學反應電位穩定的溶解于電解液的二茂鐵氧化還原電對。
關于準參比電極細節可參考A.J.Bard編著的(Electrochemical Methods)。
電極過程
電極過程一般情況下包括下列基本過程或步驟:
1、電化學反應過程:在電極/溶液界面上得到或 失去電子生成反應產物的過程,即電荷轉移過程;
2、傳質過程:反應物向電極表面或內部傳遞或反應產物自電極內部或表面向溶液中或向電極內部的傳遞過程(擴散和遷移);
3、電極界面處靠近電解液一 側的雙電層以及靠近電極內一側的空間電荷層的充放電過程;
4、溶液中離子的電遷移或電子導體、電 極內電子的導電過程。
此外,伴隨電化學反應,還有溶劑、陰陽離子、電化學反應產物的吸附/脫附過程,新相生長過程以及其它化學反應等。
典型的電極過程及動力學參數
離子在電解質中的遷移電阻(Rsol);離子在電極表面的吸附電阻和電容(Rad,Cad);電化學雙電層電容(Cdl);空間電荷層電容(Csc);離子在電極電解質界面的傳輸電阻(Rincorporation);離子在表面膜中的輸運電阻和電容(Rfilm,Cfilm);電荷轉移(Rct);電解質中離子的擴散電阻 (Zdiffusion);電極中離子的擴散(Zdiffusion)——體相擴散(Rb)和晶粒晶界中的擴散(Rgb);宿主晶格中外來原子/離子的存儲電容(Cchem);相轉 變反應電容(Cchem);電子的輸運(Re)。
值得注意的是,不同電極過程的響應時間不同,總的來說:電荷轉移<表面反應<電子傳輸<界面擴散<固相反應<體相擴散,因此離子在電極、電解質材料內部的擴散以及固相反應一般是速率控制步驟。
極化及類型
在施加了外來電場后,電池或電極逐漸偏離平衡電勢的狀態,稱之為極化。極化電勢與平衡電勢的差值的大小被稱之為過電勢。
在不具有流動相的電池中,存在著3種類型的極化:
1、化學極化—— 與電荷轉移過程有關的極化,極化的驅動力是電場梯度。電化學極化的大小是由電化學反應速率決定的,電化學極化電阻(Rct)的大小與交換電流密度直接相關。
2、濃差極化——與參與電化學反應的反應物和產物的擴散過程有關的極化,極化的驅動力為濃度梯度。濃差極化與傳質粒子的擴散系數有關。
3、歐姆極化——與載流子在電池中各相輸運有關的極化,驅動力是電場梯度。歐姆極化的大小是由電池內部涉及到電遷 移的各類電阻之和,即歐姆電阻決定的。
若還存在其它基本電極過程,如勻相或多相化 學反應過程,則可能存在化學反應極化。
電化學測量方法在鋰電池中的經典應用
鋰離子電池電極材料在電池充放電過程中一般經歷以下幾個步驟:
1、劑化的鋰離子從電解液內 遷移到電解液/固體電極的兩相界面;
2、溶劑化的鋰 離子吸附在電解液/固體電極的兩相界面;
3、去溶劑化;
4、電荷轉移,電子注入電極材料的導帶,吸附態的鋰離子從電解液相遷移至活性材料表面晶格;
5、鋰離子從活性材料表面晶格向內部擴散或遷移;
6、電子從集流體向活性材料的遷移。
循環伏安法
常用于電極 反應的可逆性、電極反應機理(如中間體、相界吸 /脫附、新相生成、偶聯化學反應的性質等)及電極反應動力學參數(如擴散系數、電極反應速率常數等)的探究。
電勢向陰極方向掃描時,電活性物質在電極上還原,產生還原峰;向陽極方向掃描,還原產物重新在電極上氧化,產生氧化峰。因而一次掃描,完成一個還原和氧化過程的循環,其電流一電壓曲線稱為循環伏安曲線。
通過循環伏安曲線的氧化峰和還原峰的峰高、對稱性、氧化峰與還原峰的距離,中點位置,可判斷電活性物質在電極表面反應的可逆程度和極化程度。如果氧化與還原反應的過電位 差別不大的化,還可以把一對氧化峰與還原峰之間的中點值近似作為該反應的熱力學平衡電位值。
另外恒電流充放電的電壓容量曲線微分后以dQ/dV 作為縱軸,橫軸為電壓,可以獲得與CV曲線十分相似的結果,其實本質并沒區別。
循環伏安法計算鋰離子擴散系數
注意:僅適用于擴散過程為控制步驟且電極為可逆體系,此時有公式
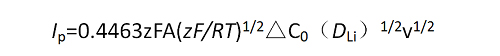
常溫時,
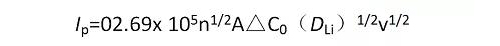
式中,Ip為峰電流的大小,n為參與反應的電子數,A為浸入溶液中的電極面積,F為法拉第常數,DLi為Li在電極中的擴散系數,v為掃描速率,△C0為反應前后待測濃度的變化。
可以按如下步驟來計算:
1、測量電極材料在不同掃描速率下的循環伏安曲線;
2、將不同掃描速率下的峰值電流對掃描速率的平方根作圖;
3、對峰值電流進行積分,測量樣品中鋰的濃度變化;
4、將相關參數帶入式(2),即可求得擴散系數。
需要注意的是,由于以下幾個原因,其測得的絕對值在不同文獻中不盡相同
需要該反應收擴散控制,而且循環伏安測到的化學擴散系數并非電極材料內部本征的離子擴散系數(詳細內容請見擴展閱讀)。還有就是,如果是多孔粉末電極,其真實反應面積遠大于電極幾何面積,且難以精確測量,給結果帶來很大的不確定性。
當然,關于循環伏安法原理使用等,我們會另外詳細介紹。
恒電流間歇滴定技術
恒電流問歇滴定技術(galvanostatic intermittent titration technique)由德國科學家W.Weppner提出, 基本原理是在某一特定環境下對測量體系施加一恒 定電流并持續一段時問后切斷該電流,觀察施加電流段體系電位隨時間的變化以及弛豫后達到平衡的電壓,通過分析電位隨時閭的變化可以得出電極過 程過電位的弛豫信息,進而推測和計算反應動力學信息。
當體系滿足如下條件時,可以計算鋰離子擴散系數
1、電極體系為等溫絕熱體系;
2、電極體系在施加電流時無體積變化與相變;
3、電極響應完全由離子在電極內部的擴散控制;
4、τ≤L2/D,L為離子擴散長度;
5、電極材料的電子 電導遠大于離子電導等條件
計算公式如下:
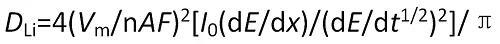
式中,DLi為“在電極中的化學擴散系數,Vm為活性物質的體積,A為浸入溶液中的真實電極面積,F為法拉第常數,n為參與反應的電子數目,I0為滴定電流值,dE/dx為開路電位對電極中Li濃度曲線上某濃度處的斜率(即庫侖滴定曲線),dE/dt1/2為極化電壓對時間平方根曲線的斜率。
利用GITT方法測量電極材料中的鋰化學擴散系數基本過程如下:在電池充放電過程中的某一 時刻,施加微小電流并恒定一段時間后切斷;記錄電流切斷后的電極電位隨時間的變化;做出極化電壓對時間平方根曲線,即dE/dt1/2曲線;測量庫侖滴定曲線,即dE/dx曲線;代入相關參數,利用公式求解擴散系數。
恒電勢間歇滴定技術
恒電位間歇滴定技術(potentiostatic intermittent titration technique)是通過瞬時改變電極電位并恒定 該電位值,同時記錄電流隨時間變化的測量方法。通過分析電流隨時間的變化可以得出電極過程電位弛豫信息以及其它動力學信息, 類似于恒電位階 躍,只是PITT是多電位點測量。
使用恒電位間歇滴定技術測量鋰離子化學擴散系數公式如下:
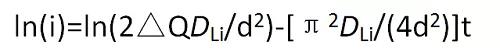
式中,i為電流值,t為時間,△Q為嵌入電極的電量,DLi為Li在電極中的擴散系數,d為活性物質的厚度。
基本操作如下:以恒定電位步長瞬間改變電 極電位,記錄電流隨時間的變化;利用ln(i)一t曲線;截取ln(i)一t曲線線性部分的數據,求斜率即可求出鋰離子化學擴散系數。
電位弛豫技術
電位弛豫技術(potential relax technique)是在電池與外界無物質和能量交換的條件下研究電極電 勢隨時間的變化關系,該方法屬于電流階躍測量方 法中的斷電流法,與GITT實驗方法一致,不同的是分析弛豫過程中的電位變化。該方法最早由中國科學院物理研究所王慶等運用于鋰離子電池電極材料中的離子擴散動力學研究。
計算公式為:
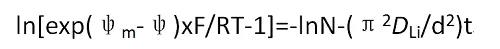
式中,ψm為平衡電極電位,ψ為初始電位,R 為氣體常數,T為絕對溫度,d為活性物質的厚度,DLi為Li在電極中的擴散系數,t 為電位達到平衡時的時間。
具體測量步驟如下:對電池預充放電,使電池的庫侖效率降至97%左右;在電池充/放電到一 定程度時,切斷電流,采用CPT(chrono potentiometry technique)記錄電壓隨時問的變化曲線;運用公式對ln[exp(ψm-ψ)xF/RT-1]-t作圖,并對后半部分作線性擬合;ln[exp(ψm-ψ)xF/RT-1]-t曲線進行擬合,求解擬合曲線斜率,帶公式即可求得鋰的化學擴散系數。
運用電位弛豫技術測量電極過程動力學信息需要滿足一定的前提條件。通常,鋰離子電池在首 周充放電過程中伴隨著一些副反應,典型的副反應 為SEI膜的形成,為避免副反應的發生對鋰離子化 學擴散系數測量所帶來的干擾,通常電池需要進行 幾個充放電循環之后開始測量其化學擴散系數。此 外,由于電位弛豫是一個非常緩慢的過程,一般在 8 h左右,在經過長時間的弛豫后,電位仍不能達到平衡狀態,則有可能是儀器漏電所造成,需要特別注意。
本文鏈接:http://www.qhgfjy.com.cn{dede:field.arcurl/}
諾信新聞,諾信公司新聞,鋰電池行業新聞,展會新聞









